- FDA, 신약 후보 33개는 첫 승인, 12개는 적응증 추가 바카라사이트 아벤카지노
- 버텍스의 낭포성 섬유증 치료제, 1월 2일부터 바카라사이트 아벤카지노 결과 발표
- 3월 20일 ‘리보세라닙·캄렐리주맙 병용요법’ 바카라사이트 아벤카지노 결과 공개 예정
[더바이오 성재준 기자] 올해 낭포성 섬유증부터 암 치료제까지 다양한 질환을 겨냥한 신약 후보들이 미국 식품의약국(FDA) 승인을 기다리고 있다. 이들 신약 후보물질은 환자들의 삶을 변화시킬 잠재력을 지니고 있다는 평가로 기대를 모은다. 특히 우리나라 바이오 벤처인 HLB(에이치엘비)의 간암신약 후보물질인 ‘리보세라닙’도 품목허가 승인을 앞두고 있어 이목이 집중된다.
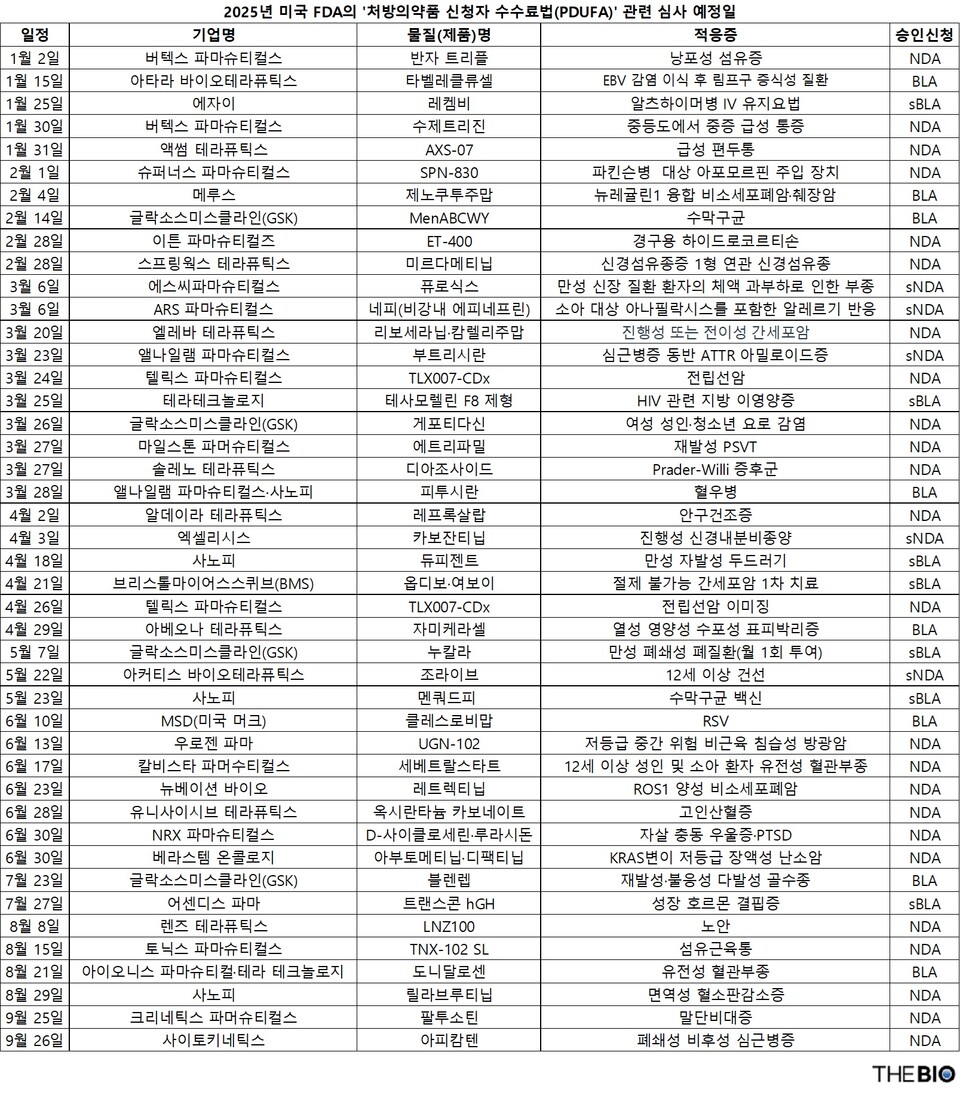
2일 <더바이오>가 자체 집계한 결과, FDA는 ‘처방의약품 신청자 수수료법(PDUFA)’에 따라 2025년 1월부터 9월까지 총 45개 약물의 승인을 검토할 예정이다. 이 중 33개는 신약 후보물질로 ‘첫 승인’을 심사 중이고, 12개는 기존 약물의 ‘적응증 추가’를 심사하고 있다. PDUFA 법에 따르면, FDA는 신약 후보물질을 ‘우선심사’ 대상으로 지정할 경우 심사 기간을 기존 10개월에서 6개월로 단축한다. 하지만 경우에 따라 심사 기간을 몇 개월 연장하기도 한다.
올해 FDA가 처음으로 승인 여부를 공개할 신약은 미국 버텍스파마슈티컬스(Vertex Pharmaceuticals, 이하 버텍스)의 낭포성 섬유증 치료제 후보물질인 ‘반자 트리플(Vanza triple)’이다. FDA는 1월 2일 이 약물의 심사 결과를 공개할 예정이다. 또 버텍스는 같은달 30일 중등도~중증 급성 통증 치료제 후보물질인 ‘수제트리진(Suzetrigine)’의 신약 허가(NDA) 승인도 기다리고 있다.
메소블라스트(Mesoblast)의 ‘라이온실(Ryoncil, 성분 레메스템셀)’은 스테로이드 불응성 급성 이식편대숙주병(SR-aGVHD) 치료제로, FDA의 심사 결과가 1월 7일 공개될 예정이었지만 지난달 말 승인받았다. 라이온실은 무려 세 차례의 승인시도 끝에 미국에서 승인을 획득했다.
아타라바이오테라퓨틱스(Atara Biotherapeutics)의 ‘타벨레클류셀(tabelecleucel)’은 엡스타인-바아 바이러스 양성 이식 후 림프구 증식성 질환(EBV+PTLD) 치료제로, 심사 결과 발표일은 1월 15일이다. 두 치료제 모두 ‘희귀질환’ 치료에서 중요한 진전을 가져올 가능성이 크다.
에자이(Eisai)의 알츠하이머병 치료제인 ‘레켐비(Leqembi, 성분 레카네맙)’ 정맥주사(IV) 유지요법에 대한 FDA의 추가 생물학적 제제 허가 신청서(sBLA) 심사 결과는 1월 25일 발표될 예정이다. 해당 요법은 알츠하이머병 환자들의 장기적인 치료 지속 가능성을 크게 개선할 것으로 기대된다.
2월에는 파킨슨병 환자를 위한 슈퍼너스파마슈티컬스(Supernus Pharmaceuticals)의 아포모르핀 주입 장치인 ‘SPN-830(개발코드명)’와 뉴레귤린1(NRG1) 융합 비소세포폐암 및 췌장암 치료제 후보물질인 메루스의 ‘제노쿠투주맙(zenocutuzumab)’이 각각 NDA 및 BLA 승인을 목표로 하고 있다. 이외에도 글락소스미스클라인(GSK)의 수막구균 백신 후보물질인 ‘MenABCWY’와 스프링웍스테라퓨틱스(SpringWorks Therapeutics)의 신경섬유종증 1형 연관 신경섬유종 치료제 후보물질인 ‘미르다메티닙(Mirdametinib)’ 등이 2월 말까지 FDA의 승인을 기다리는 상황이다.
3월에는 FDA가 에스씨파마슈티컬스(scPharmaceuticals)의 ‘퓨로식스(FUROSCIX, 성분 푸로세미드)’와 ARS파마슈티컬스의 ‘비강 내 에피네프린’의 보충 신약 허가 신청(sNDA)를 각각 검토할 예정이다. 퓨로식스는 만성 신장질환 관련 체액 과부하로 인한 부종 치료제이며, 비강 내 에피네프린은 소아 아나필락시스 치료를 목적으로 한다. 특히 3월 20일에는 HLB의 미국 자회사인 엘레바테라퓨틱스가 진행성 또는 전이성 간세포암 치료를 위한 ‘리보세라닙·캄렐리주맙 병용요법’에 대한 FDA 승인 심사 결과가 나올 예정이다.
아직 심사 결과일이 공개되지는 않았지만, 2월 24일에는 노바티스(Novartis)의 보체3 사구체 병증(C3G)을 적응증으로 한 경구용(먹는) 약물인 ‘파브할타(FABHALTA, 성분 이프타코판)’에 대한 sNDA 승인 여부를 논의할 예정이다. 노바티스는 또 현재 화학요법 경험이 없는 호르몬 민감성 전립선암 환자를 대상으로 방사성리간드의약품(Radioligand Therapy, RLT)인 ‘플루빅토(Pluvicto, 성분 루테튬(177Lu) 비피보타이드테트라세탄)’에 대한 FDA 심사가 진행 중이다. 승인 여부는 올해 안에 결정될 가능성이 높다. 승인이 이뤄지면, 초기 전립선암 환자를 대상으로 플루빅토의 적응증이 확대될 전망이다.

