간암 환자 50명 대상 1차 표준요법인 '아테졸리주맙+베바시주맙'과 바카라사이트 유니벳001 병용 평가
[더바이오 지용준 기자] 알지노믹스는 개발 중인 항암제 후보물질인 'RZ-001(개발코드명)'과 면역항암제를 병용하는 1b·2a상 임상시험계획에 대해 식품의약품안전처에 이어 미국 식품의약국(FDA)으로부터 승인을 받았다고 19일 밝혔다.
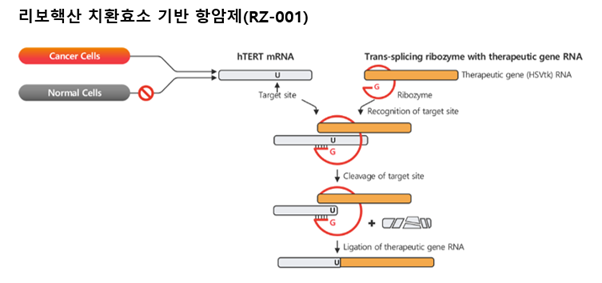
'간세포암'으로 진단받은 환자 약 50명을 대상으로 1차 표준치료제(아테졸리주맙+베바시주맙)와 함께 RZ-001을 병용 투여해 유효성과 안전성을 함께 평가하겠다는 계획이다. RZ-001은 바카라사이트 유니벳가 보유한 리보핵산 치환효소 플랫폼 기술을 적용해 개발 중인 항암제 후보물질이다. 아데노 바이러스를 벡터로 리보핵산(RNA) 효소를 전달해 암세포에 특이적으로 발현하는 '텔로머레이즈(hTERT) RNA'를 표적한다.
정상세포는 '텔로미어'가 점점 짧아지고, 얼마 남지 않게 되면 스스로 '늙었다'고 인식해 더 이상 분열을 하지 않고 사멸된다. 암세포에서는 줄어드는 텔로미어 길이를 다시 늘리는 효소인 '텔로머레이즈'가 과활성돼 텔로미어가 계속 길어지는 경우가 있다. 암세포가 사멸하지 않고 계속 분열하게 되는 원인으로 꼽힌다.
회사에 따르면 바카라사이트 유니벳001은 암세포가 된 간세포의 hTERT RNA를 제거해 텔로머레이즈가 발현되지 않도록 한다. 텔로미어가 정상적으로 짧아지도록 만들어 세포 사멸을 유도하는 것이다. 또 잘라낸 hTERT 자리에 HSV(Herpes simplex virus) 유래 유전자(HSV-TK)가 발현되도록 했다. 바카라사이트 유니벳001과 함께 투약하는 항바이러스제(발간시클로버)는 이 유전자에 반응해 암세포만 선택적으로 공격한다. 암세포의 무한 증식을 일으키는 텔로머레이즈 유전자를 제거하고, 바이러스 유래 유전자를 집어넣어 항바이러스제가 암세포를 공격하게끔 하는 이중 기전이다.
이번에 FDA에서 승인받은 임상은 간세포암 1차 치료에서 가장 널리 쓰이는 '티쎈트릭(성분 아테졸리주맙)+아바스틴(성분 베바시주맙)'과 조합을 했다. 기존 치료법 대비 차별화된 안전성과 효능을 입증할 경우 1차 치료제라는 가장 큰 시장에 침투할 수 있는 길이 열릴 것으로 회사는 전망했다. 바카라사이트 유니벳는 이번 임상을 국내외 대형 제약사와 협력할 계획이다. 임상약 중 아테졸리주맙은 다국적 제약사 로슈로부터, 베바시주맙은 국내 대형 바이오기업인 셀트리온으로부터 공급받기로 계약이 돼 있다.
RZ-001은 '악성교모세포종'을 대상으로도 이미 식약처와 FDA로부터 IND를 승인받아 임상1/2a상을 진행 중에 있으며, 적용 암종을 확대해 신약의 가치를 극대화시켜 나갈 계획이다. 이성욱 알지노믹스 대표는 "RZ-001 임상 개발에 많은 연구자와 기관들이 협력해 주는 만큼 혁신적 항암제로 성공할 수 있도록 최선을 다하겠다"고 말했다.
