미국과 국내 고형암 환자 51명 대상…안전성·내약성·약동학적 특성 평가
[더바이오 지용준 기자] 오스코텍은 미국 식품의약국(FDA)이 EP2·4 이중저해제 후보물질인 ‘OCT-598(개발코드명)’의 임상1상 시험계획(IND)을 승인했다고 2일 밝혔다.
이번 임상1상은 미국과 국내에서 최대 51명의 진행성 고형암 환자를 대상으로 OCT-598의 안전성, 내약성 및 약동학적 특성을 평가할 예정이다. 우선 OCT-598 단독 투여로 용량 증량, 안전성을 평가하고(Part A), 이후 ‘도세탁셀(Docetaxel)’과의 병용투여로 용량 증량, 최대 내성 용량 및 임상2상에 적합한 용량을 설정(Part B)할 계획이다.
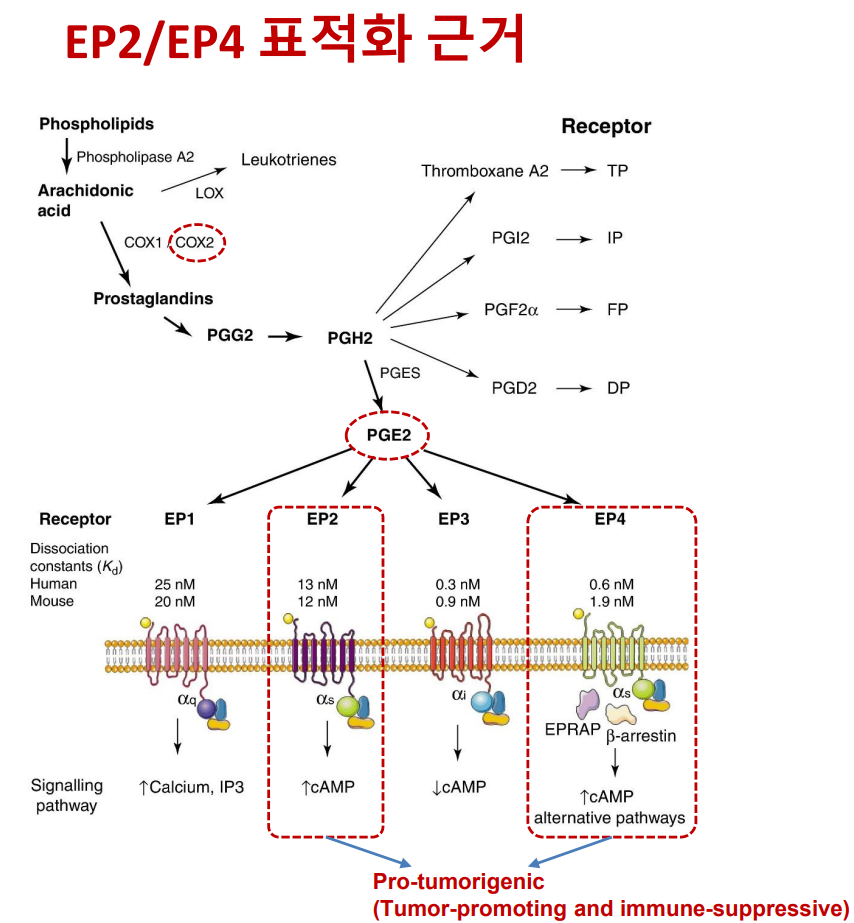
OCT-598은 암세포 사멸 과정에서 활성화돼 종양 재생을 돕는 ‘프로스타글란딘E2(PGE2)’의 수용체인 ‘EP2’와 ‘EP4’를 저해함으로써 치료제 내성 발현 및 면역 회피를 차단하고, 암의 재발과 전이를 막는 후보물질이다.
해당 파이프라인은 지난 2022년 카나프테라퓨틱스로부터 기술을 도입한 이후 자체적으로 비무료 바카라 게임 연구를 진행해왔다. 최근 3년 간 2번에 걸쳐 미국암연구학회(AACR)에서 병용투여 시 항종양 효과에 대해 발표했다.
오스코텍은 지난 4월 개최한 AACR에서도 OCT-598이 암세포의 화학항암제에 대한 저항성 발현을 차단하는 기전을 확인, 마우스실험을 통해 도세탁셀 혹은 방사선요법과의 병용 모델에서 종양의 성장을 억제하고 재발을 막는 ‘항내성제(Anti-resistance Therapy)’로서의 효능을 재확인한 연구 결과를 공개한 바 있다.
지용준 기자
jyj@thebionews.net
