- 기술이전 플랫폼·파이프라인, 글로벌 기업 핵심 라인업으로 부상
- JP모건서 중장기 성장 전략 공개…MSD, ‘키트루다SC’로 시장 방어
- 한미 MASH 치료제 후보물질도 상반기 중 톱라인 공개, 개발 의지 확인
- BMS, 2030년 신약 로드맵에 오름 DAC 물질 포함…포트폴리오 확장
- 컴퍼스, 에이비엘바카라사이트 아벤카지노 ‘ABL001’ 임상 순항…차세대 옵션으로 제시
- 앱클론 파트너사 헨리우스도 ‘AC101’ 기대감 드러내
- 업계 “상업적 가치, 경쟁력서 역량 확인…‘K바카라사이트 아벤카지노’ 위상 제고”

[더바이오 유수인 기자] 국내 바이오기업들이 기술이전(L/O)한 신약 파이프라인이 글로벌 빅파마의 ‘주력 성장 엔진’으로 자리 잡고 있다. 알테오젠 기술이 적용된 ‘키트루다’ 피하주사(SC) 제형을 비롯해 오름테라퓨틱(이하 오름)의 항체분해약물접합체(DAC) 후보물질, 에이비엘바이오의 이중항체 기반 항암신약 후보물질 등이 글로벌 파트너사의 중장기 성장 전략에서 핵심 라인업으로 부상하며 ‘K바이오’ 기술 가치가 본격적으로 입증되고 있다는 평가가 나온다.
19일 업계에 따르면, 최근 미국 샌프란시스코에서 열린 ‘2026 JP모건 헬스케어 콘퍼런스’에서는 주요 글로벌 제약바이오 기업들이 현재 개발 중인 핵심 파이프라인들의 임상 진행 현황과 중장기 전략 등을 공개하며 차세대 성장동력을 구체화했다.
다국적 제약사 MSD(미국 머크)는 알테오젠의 SC 제형 전환 플랫폼이 적용된 면역항암제 ‘키트루다’의 SC 제형인 ‘키트루다 큐렉스(QLEX)’를 앞세워 특허 만료(LOE) 충격을 최소화하고, 미국 시장 침투에 속도를 내겠다는 전략을 제시했다. 키트루다는 미국에서 핵심 특허가 2028년 만료를 앞두고 있다.
앞서 MSD는 2020년 알테오젠의 SC 전환 플랫폼인 ‘ALT-B4’를 비독점 방식으로 도입했다. 이후 2024년 2월 ALT-B4를 독점 사용하도록 계약을 전환한 후 ‘키트루다 큐렉스(이하 큐렉스)’를 상용화했다. ALT-B4 기술 적용으로 큐렉스는 기존 정맥주사(IV)로 평균 30분 이상 걸리던 투약 시간을 1~2분으로 크게 단축했다.
이에 MSD는 향후 18~24개월 내에 미국 내 키트루다 처방에서 SC 제형 채택률이 30~40% 수준까지 확대될 것으로 전망했으며, 이를 통해 특허 만료 이후에도 매출이 유지될 수 있을 것으로 내다봤다. 즉 키트루다 특허 만료로 시장 독점권을 잃은 후에도 환자들이 복제약 대신 편의성이 높은 큐렉스를 계속 사용하도록 유도하겠다는 포석이다.
키트루다는 올해만 300억달러(43조4880억원)의 매출을 낼 것으로 전망되는 글로벌 매출 1위 의약품이다. 이에 많은 기업이 키트루다 특허 만료에 시점에 맞춰 바이오시밀러 개발에 뛰어들고 있다. MSD가 ‘포스트 키트루다’ 시대 대응 전략의 일환으로 큐렉스를 전면에 내세우면서 알테오젠의 기술력을 향한 주목도가 한층 더 커지고 있다.
또 MSD는 한미약품으로부터 도입한 대사이상 관련 지방간염(MASH) 치료제 후보물질인 ‘에피노페그듀타이드(개발코드명 MK-6024)’의 임상2상 결과도 올 상반기 공개할 것으로 전망된다. 에피노페그듀타이드는 MSD가 한미약품으로부터 총 8억7000만달러(약 1조2800억원) 규모로 도입한 신약 후보물질로, 지난달 29일 임상2상이 종료됐다. 최근 한미약품도 MSD가 올 상반기 임상2상 톱라인(Top-line) 결과를 주요 학회에서 발표할 계획이라고 밝힌 바 있어, 해당 프로그램에 대한 MSD의 개발 의지가 재확인되고 있다는 평가가 나온다.

다국적 제약사 브리스톨마이어스스퀴브(BMS)는 오름에서 도입한 DAC 후보물질인 ‘ORM-6151(BMS 개발코드명 CD33-GSPT1)’을 2030년 신약 로드맵에 포함시켰다. 해당 로드맵에는 특정 블록버스터 한두 개에 의존하지 않는 다변화된 포트폴리오를 기반으로, 2030년까지 10개 이상의 신약을 출시하고 30개 이상의 유의미한 마일스톤을 달성하겠다는 BMS의 계획이 담겼다.
‘CD33-GSPT1’은 BMS가 지난 2023년 11월 오름으로부터 총 1억8000만달러(약 2340억원) 규모에 도입한 전 세계 최초의 DAC 후보물질이다. CD33-GSPT1은 ‘CD33’을 표적하는 항체에 ‘GSPT1’을 선택적으로 분해하는 분해제(degrader)를 결합한 DAC로, 오름의 독자적인 ‘이중정밀 표적단백질분해(TPD²)’ 기술이 적용됐다. 오름의 TPD² 플랫폼은 기존 항체약물접합체(ADC)와 달리 ‘세포 살상 독성 물질’이 아닌, ‘표적 단백질을 직접 분해하는 분해제’를 페이로드(payload)로 사용한다는 점에서 차세대 기술로 평가된다.
현재 BMS는 ‘TPD’와 ‘세포치료제’를 혈액학 포트폴리오의 양대 축으로 구축하고, TPD 플랫폼의 3가지 기술(CELMoD, LDD, DAC)을 통해 ‘언드러거블(un-druggable)’로 여겨졌던 표적까지 공략하는 것을 목표로 하고 있다. 이를 위해 다발골수종 영역에서는 CELMoD 기반의 ‘이버도미드(iberdomide)’와 ‘메지그도미드(mezigdomide)’를 통해 TPD의 상업적 가능성을 키우고 있고, ‘브레얀지’와 ‘아베크마’ 등 키메라 항원 수용체 T세포(CAR-T) 치료제로 혈액암 시장의 지배력을 확대해 나가고 있다. 여기에 CD33-GSPT1이 BMS의 혈액학 전략에서 새로운 성장축으로 자리 잡을 수 있을지 주목된다.
미국 바이오기업인 컴퍼스테라퓨틱스(Compass Therapeutics, 이하 컴퍼스)는 에이비엘바이오로부터 기술도입한 이중항체 항암신약 후보물질인 ‘ABL001(개발코드명, 성분 토베시미그)’을 담도암 2차 치료 영역의 차세대 치료옵션으로 제시했다. 앞서 컴퍼스는 지난 2018년 해당 물질의 글로벌(한국 제외) 개발·상업화 권리를 에이비엘바이오로부터 이전받아 담도암 중심으로 임상 개발을 주도해왔다.
토베시미그는 ‘델타 유사 리간드4(DLL4)’와 혈관내피세포성장인자-A(VEGF-A)’를 동시에 차단하는 이중항체다. VEGF 단독 억제제 대비 내성 극복과 항암 활성 강화를 목표로 설계됐다. VEGF 억제 치료에 대한 내성을 유발하는 DLL4 신호까지 함께 억제함으로써 기존 항혈관신생 치료 이후 환자에서도 항암 효과를 기대할 수 있다는 점이 특징이다. 컴퍼스는 이러한 기전을 바탕으로 토베시미그를 ‘차세대 항혈관신생 치료제’로 규정하고 있다.
컴퍼스는 이번 JP모건 헬스케어 콘퍼런스 행사에서 토베시미그의 임상2·3상(COMPANION-002) 연구 중간 결과를 공개하며 무진행 생존기간(PFS)과 전체 생존기간(OS) 결과에 대한 기대감을 높였다. 해당 임상 분석 결과는 오는 3월 말 공개될 예정이다.
사노피(Sanofi), 일라이릴리(Eli Lilly, 이하 릴리), 글락스스미스클라인(GSK) 등 빅파마들도 에이비엘바이오의 플랫폼 기술에 주목하며 협력 범위를 넓히고 있다. 이 중 사노피는 파킨슨병 치료제 후보물질인 ‘ABL301(개발코드명)’을 대상으로 공동 개발 및 기술이전 계약을 체결한 뒤 협업을 이어오는 중이다. ABL301은 에이비엘바이오의 뇌혈관장벽(BBB) 셔틀 플랫폼인 ‘그랩바디-B(Grabody-B)’를 적용한 이중항체 후보물질로, 중추신경계(CNS) 질환에서 약물 전달 효율을 높이기 위한 전략적 자산으로 평가된다. 해당 프로그램은 미국에서 초기 임상 개발을 진행했으며, 이후 단계부터는 사노피가 글로벌 개발을 주도하는 구조다.
또 GSK는 그랩바디-B에 대해 총 21억4010만파운드(약 4조1000억원) 규모의 기술이전 계약을 체결했다. 릴리도 총 26억200만달러(약 3조8000억원) 규모의 그랩바디 기술이전과 함께 1500만달러(약 220억원) 규모의 전략적 지분 투자를 단행하며, 에이비엘바카라사이트 아벤카지노 기술을 기반으로 미래 먹거리 개발에 나서고 있다.
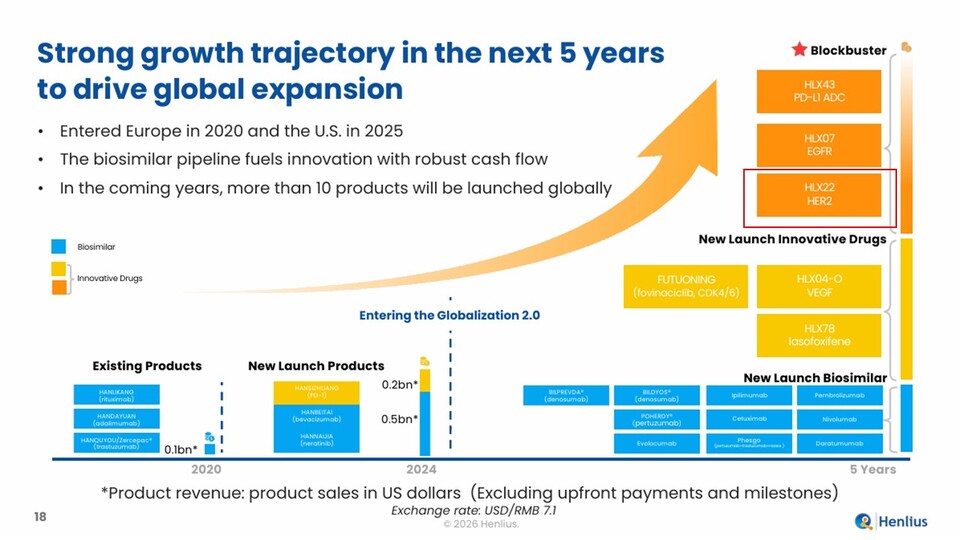
중국 바이오기업인 헨리우스(Henlius)는 자사의 중장기 성장 전략 로드맵에 국내 바이오기업인 앱클론으로부터 도입한 항체치료제 후보물질인 ‘AC101(개발코드명, HLX22)’을 핵심 파이프라인으로 포함시켰다. 헨리우스는 이번 JP모건 헬스케어 콘퍼런스에서 발표한 ‘향후 5년 성장 로드맵(Strong growth trajectory in the next 5 years)’ 자료에서 HLX22를 포함한 3개 후보물질을 ‘블록버스터(Blockbuster)’로 분류하는 등 기대감을 드러냈다.
앞서 헨리우스는 지난 2016년 10월과 2018년 11월 2차례에 걸쳐 해당 파이프라인을 도입하고, 위암 및 유방암 등을 적응증으로 임상을 진행하고 있다. 이 중 인간 상피세포 성장인자 수용체 2(HER2) 저발현(Low) 유방암을 대상으로 하는 ADC 병용요법의 임상2상 결과는 오는 상반기 내 공개될 것으로 보인다.
아울러 ‘트라스투주맙+화학요법’과의 병용요법을 평가하는 AC101 글로벌 임상3상(HLX22-GC-301)도 순항 중이다. 지난 2024년 11월 첫 환자 투약 이후 14개월 만에 40% 이상 환자 모집을 완료했다. 이같은 속도는 AC101에 대한 의료 현장의 높은 기대감이 반영된 결과로 풀이된다.
이와 함께 HLX22는 다양한 ADC 치료제의 효능을 높이는 ‘플랫폼 항체’로서의 범용적 가치까지 입증받고 있다. 헨리우스는 앱클론의 ‘HLX22’를 기반으로 개발한 ‘HLX49(개발코드명, HER2 이중항체 ADC)’도 차세대 유망 파이프라인으로 소개했다.
연내 임상 진입을 목표로 연구를 진행 중인 ‘HLX49’는 ‘HLX22’와 ‘허셉틴 바이오시밀러(개발코드명 HLX02)’를 결합한 이중항체 ADC 후보물질이다. HLX22의 특수한 결합 부위가 암세포의 내재화(Endocytosis)를 촉진해 약물 침투력을 극대화하는 것으로 나타났다. 앱클론 관계자는 “ADC 플랫폼으로의 확장성까지 확인된 만큼, 기업가치 재평가가 가속화될 것”이라고 밝혔다.
한 업계 관계자는 “국내 기술이 적용된 플랫폼과 신약 후보물질들이 글로벌 빅파마들의 핵심 성장축으로 자리 잡는다는 것은 매우 고무적”이라며 “단순 검증 단계를 넘어, 상업적 가치와 경쟁력으로 평가 범위가 확장되며 기술력을 인정받는 모습”이라고 평가했다. 그러면서 “이런 흐름은 국내 제약바이오 업계 전반의 신뢰도를 끌어 올려 추가 기술이전 및 공동 개발 등으로 연결될 수 있을 것”이라고 덧붙였다.

