지난해 한국 기업 5개로 선두
[더바이오 성재준 기자] 미국 식품의약국(FDA)이 지난해 한 해 동안 총 18개의 바이오시밀러를 승인하며 역대 최대 허가 기록을 세운 것으로 나타났다. 이 중 한국 기업이 5개 품목을 허가받아, 2년 연속 국가별 승인 건수 1위를 기록했다.
27일 한국바이오협회 바이오경제연구센터는 ‘2025년 미국 FDA 바이오시밀러 허가 현황’ 보고서를 공개하며 이같이 밝혔다. 해당 보고서는 지난해 FDA 바이오시밀러 승인 건수를 국가별·연도별로 분석해, 한국 기업의 글로벌 바이오시밀러 경쟁력 강화 흐름을 분석했다.
보고서에 따르면, 바이오시밀러 허가 제도는 FDA가 승인한 참조의약품과 안전성·순도·효능에서 임상적으로 의미 있는 차이가 없음을 입증할 경우 적용되는 축약 승인 경로다. 이를 통해 치료 옵션을 확대하고 환자 접근성을 높이는 한편, 경쟁을 통한 약가 인하 효과도 기대할 수 있다는 게 보고서의 분석 내용이다.
지난해 승인된 18개 바카라 중에는 기존에 바이오시밀러가 없었던 오리지널의약품(참조의약품) 3종을 대상으로 한 4개 바이오시밀러 품목도 포함됐다. 이 중 3개는 상호교환성(interchangeable) 바이오시밀러로 승인돼, 주(州) 법에 따라 처방의 개입 없이 약국에서 참조의약품으로 대체 조제가 가능하다.
상호교환성 바이오시밀러로는 ‘노보로그(Novolog, 성분 인슐린 아스파트)’를 참조의약품으로 하는 ‘메릴로그(Merilog, 성분 인슐린 아스파트)’, ‘졸레어(Xolair, 성분 오말리주맙)’를 대체하는 ‘옴리클로(Omlyclo, 성분 오말리주맙)’, ‘퍼제타(Perjeta, 성분 퍼투주맙)’를 참조한 ‘포허디(Poherdy, 성분 퍼투주맙)’가 포함됐다.
승인된 바이오시밀러 중 국적별로는 한국이 5개로 가장 많았고, 인도 4개, 독일·중국 각 3개, 미국 2개, 영국·프랑스 각 1개 순으로 집계됐다.
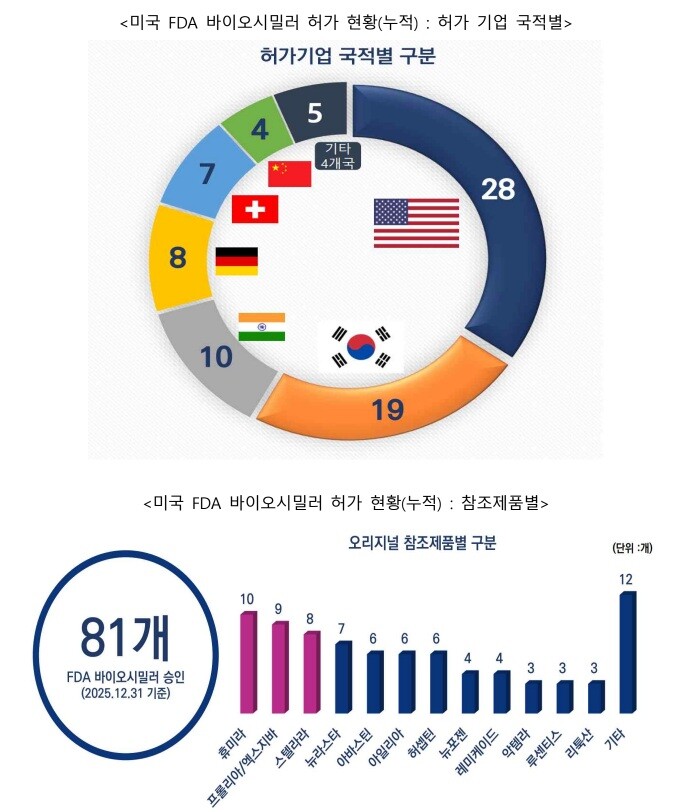
보고서는 또 2015년부터 지난해까지 FDA가 20개 참조의약품을 대상으로 총 81개의 바카라를 승인했다고 정리했다. 품목별로는 ‘휴미라(Humira, 아달리무맙)’가 10개로 가장 많았고, ‘프롤리아/엑스지바(Prolia/Xgeva, 데노수맙)’ 9개, ‘스텔라라(Stelara, 우스테키누맙)’ 8개, ‘뉴라스타(Neulasta, 페그필그라스팀)’ 7개 순으로 집계됐다.
연도별로는 2024년과 지난해 각각 18개로 가장 많은 바카라가 허가됐으며, 누적 기준 국적별 승인 건수는 미국 28개, 한국 19개, 인도 10개 순으로 나타났다.
한국바이오협회는 “한국 기업이 2년 연속 미국 FDA 바이오시밀러 최다 승인국을 기록한 것은 글로벌 시장에서의 개발 역량과 규제 대응력이 동시에 강화되고 있음을 시사한다”고 평가했다.
한편 2026년 들어 FDA가 처음 승인한 바이오시밀러는 미국 어코드 바이오파마(Accord BioPharma)의 ‘필크리(Filkri, 필그라스팀-라하)’로, 지난 1월 15일 ‘뉴포젠(Neupogen, 필그라스팀)’을 참조의약품으로 허가받았다.

