- 1차 평가변수 미충족…중증 환자 하위군서만 제한적 유효성 신호
- 추가 분석은 학회 발표 예정…내년부터 면역·비만·뇌전증에 R&D 집중
- JP모건 헬스케어 콘퍼런스서 핵심 파이프라인 업데이트 예고

[더바이오 성재준 기자] 미국 바이오기업 바이오헤븐(Biohaven)은 주요우울장애(MDD) 치료제 후보물질인 ‘BHV-7000(개발코드명)’의 임상2상에서 1차 평가변수를 충족하지 못하면서 정신질환 분야 추가 임상 개발을 중단하기로 했다. 회사는 향후 면역·비만·뇌전증 등 핵심 파이프라인에 역량을 집중할 방침이다.
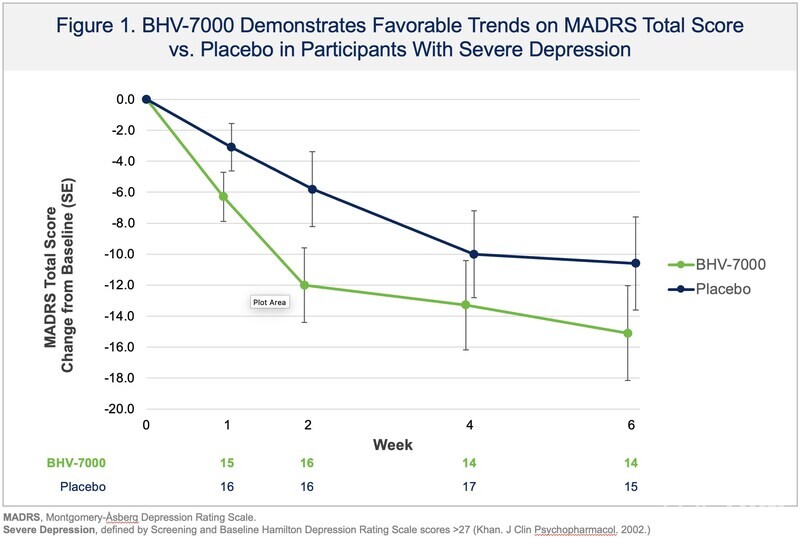
바이오헤븐은 24일(현지시간) MDD 환자를 대상으로 진행한 BHV-7000의 탐색적 임상2상(개념증명, proof-of-concept) 연구 결과를 공개했다. 이번 임상은 주요우울장애(MDD) 환자를 대상으로 BHV-7000의 6주간 치료 효과를 평가한 탐색적 임상2상으로, 무작위 배정·위약 대조 방식으로 진행됐다. 1차 평가변수는 몽고메리–아스베리 우울척도(MADRS) 점수 변화로 설정됐다.
해당 임상 분석 결과, BHV-7000 투여군은 위약 대비 통계적으로 유의미한 증상 개선을 보이지 못했다. 다만 스크리닝 및 기저 시점에서 중증 우울 증상을 보인 환자군 등 일부 임상적으로 의미 있는 하위군에서는 주요·부차적 평가지표 전반에서 BHV-7000에 유리한 경향이 관찰됐다.
안전성 측면에서는 전반적으로 양호한 결과가 확인됐다. 이상반응은 대부분 경증 또는 중등도였으며, 자연적으로 해소됐다. 5% 이상 발생한 이상반응은 두통과 오심이었고, 발생률은 에볼루션 바카라7000 투여군과 위약군 간 큰 차이를 보이지 않았다.
특히 중추신경계(CNS) 관련 이상반응 발생률은 낮았으며, 이는 에볼루션 바카라7000이 GABA 활성을 갖지 않는 기전적 특성과 기존 연구에서 확인된 안전성 데이터와 일치한다고 회사는 설명했다.
바이오헤븐은 현재 추가 분석을 진행 중이며, 관련 결과를 향후 학술대회에서 발표할 계획이다. 다만 이번 하위군 분석은 가설 생성 수준으로 평가하고, 2026년 전략적 자원 배분 차원에서 정신질환 분야의 추가 임상시험은 진행하지 않기로 했다. 대신 면역질환·비만·뇌전증을 핵심 우선순위 영역으로 설정하고, 연구개발(R&D) 역량을 집중할 방침이다.
아메드 타신(Ahmed Tahseen) 바이오헤이븐 우울증 개발 책임자는 “우울증은 새로운 기전의 치료제가 절실히 필요한 질환”이라며 “이번 연구가 광범위한 환자군에서 BHV-7000의 유효성을 입증하지는 못했지만, 새로운 치료 접근법을 평가하는데 기여했다는 점에서 의미가 있다”고 말했다.
한편 바이오헤븐은 내년 1월 미국 샌프란시스코에서 열리는 JP모건 헬스케어 콘퍼런스에서 임상 파이프라인 전반에 대한 업데이트를 공개할 예정이다. 이 자리에서는 IgA 신증 치료제 후보물질인 ‘BHV-1400(개발코드명)’과 그레이브스병 치료제 후보물질인 ‘BHV-1300(개발코드명)’을 대상으로 한 세포외 분해제(extracellular degrader) 프로그램의 초기 임상 데이터와 함께, 비만 치료제 후보물질인 ‘탈데프그로벱 알파’의 임상2b상 진행 현황, 종양학 자산, 성인 국소 뇌전증을 대상으로 한 BHV-7000의 별도 임상시험 데이터 등을 소개할 계획이다.